CLINICAL RESEARCH 臨床研究について
再発・進行性髄膜腫に対する抗PD-1抗体療法の
医師主導による多施設共同第II相臨床試験 (MENIVO試験)
慶應義塾大学病院では、手術及び放射線療法後の再発・進行性髄膜腫(WHO Grade I~III)に対して、抗PD-1抗体療法の有効性及び安全性を検討する医師主導治験を行っています。
対象となる病気に対して、新しい薬の「効果」や「副作用」を確認し、国に承認申請するための試験のことを「治験(ちけん)」といいます。 治験は、国が定めたルール(医薬品の臨床試験の実施の基準に関する省令:GCP)を守って行われます。 平成15年に薬事法(現在は「薬機法」と呼ばれています)という法律の改正により、今までのような製薬企業が主体の治験の他に、医師自らが主導して実施する治験「医師主導治験」の実施が可能になりました。 今回ここで説明する治験は、その「医師主導治験」です。
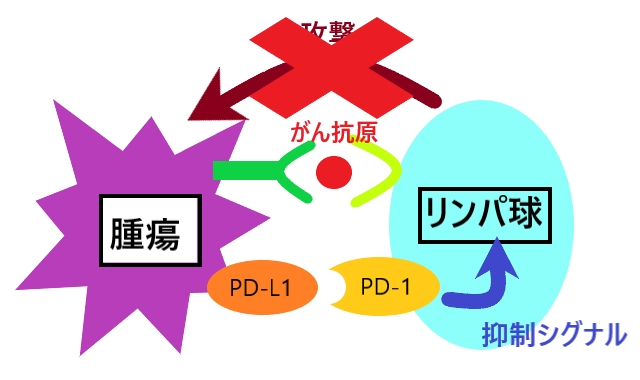
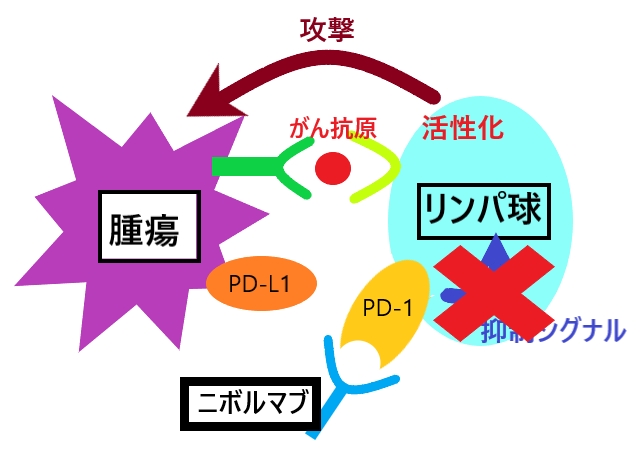
近年、PD-1/PD-L1などの免疫チェックポイント分子が、がんや腫瘍の増殖や進行にかかわっていることが報告されています。 髄膜腫では、PD-1と結合するPD-L1の発現が悪性であるほど高いことがこれまでの研究で示されており、PD-1/PD-L1シグナルに代表される免疫チェックポイントが難治性髄膜腫の増殖や進行にかかわっている可能性が考えられます。
治験の概要
手術及び放射線療法後の再発、あるいは進行性髄膜腫の患者さんで、治験責任医師等が本治験の対象として適当と判断した方を登録します。治療期では、28日間(4週間)を1コースとして、各コースの1日目に治験薬(抗PD-1抗体)を投与します。治験薬の投与基準を満たした患者さんには、治験薬の投与を初回投与から365日(1年)まで繰り返します。投与期間中や終了後、投与中止後には有効性や安全性などを評価します。
対象
満20歳以上80歳未満で、髄膜腫(WHO Grade I~III)に対する腫瘍摘出術及び放射線療法による治療歴があり、直近の髄膜腫に対する治療以降、髄膜腫の再発あるいは進行が確認されている方を対象とします。安全性・有効性を考慮して、重複がんやその他重篤な合併症、または抗体療法を実施された既往のある方などは対象となりません。
【選択基準(一部抜粋)】
- 1) 年齢:(同意取得時)満20歳以上80歳未満。
- 2) 組織学的に、WHO分類で髄膜腫(Grade I, II, III)と診断されている。
- 3) 髄膜腫に対する腫瘍摘出術及び放射線療法による治療歴がある。
- 4) 直近の髄膜腫に対する治療以降、髄膜腫の再発あるいは進行が確認されている。
- 5) 腫瘍摘出手術から4週間、放射線治療/化学療法/薬物療法/免疫療法から12週間以上の期間が経っている。
- 6) 頭部造影MRIにおいて、測定可能病変を有する。
- 7) 腫瘍組織検体を提出できる。
- 8) 身の回りのことが自分でできる(KPS≧70%)。
実施施設
本研究の実施期間
登録期間:西暦2019年8月〜2022年7月
実施期間:西暦2019年8月〜2023年8月
*治験の内容についてさらに詳しくお知りになりたい方は、下記のURLをご覧下さい。
jRCT(臨床研究実施計画・研究概要公開システム)
https://jrct.niph.go.jp/, 臨床試験実施計画番号2031190074
問い合わせ先
慶應義塾大学医学部 脳神経外科学教室
担当者:佐々木、釜本、西本、笹尾
Tel: 03-5363-3808 月曜~金曜(祝日を除く)9時~17時